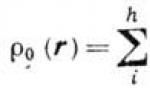Не имеют кристаллической структуры. Основные характеристики кристаллических структур. Типы кристаллических решеток
Изложенное выше позволяет дать следующее определение понятию «кристаллическая структура». Кристаллическая структура – это такая структура, которой свойственно упорядоченное расположение частиц в строго определенных точках пространства, которые образуют кристаллическую решетку. Эта упорядоченность позволяет экспериментально и теоретически полностью изучить структуру твердого состояния и явления, связанные с природой сил взаимодействия в кристаллических телах.
Для каждого кристалла характерна анизотропность и резко выраженная температура перехода в жидкое состояние. Кристаллы характеризуются внешней симметрией в расположении частиц, которая выражается наличием трех элементов симметрии: центра, оси и плоскости симметрии. Центр симметрии – точка, делящая пополам все соединительные между внешними поверхностями кристалла прямые линии, проведенные через нее по любому направлению. Плоскость симметрии делит кристалл на две части, относящиеся друг к другу, как предмет к своему зеркальному отражению. Ось симметрии – это такая линия, при повороте вокруг которой на определенный угол получается полное совпадение нового положения с прежним. Чем больше элементов симметрии, тем выше внешняя симметрия кристалла. Идеально симметричной фигурой является шар.
В настоящее время все многообразие кристаллических форм по сочетанию элементов симметрии (сингонии) сводится к семи типам: правильная (кубическая), тригональная, гексагональная, тетрагональная, ромбическая, моноклинная и триклинная. В таблице 3.2. приведена классификация кристаллов по сингонии.
Таблица 3.2. Классификация кристаллов по сингонии
Кристаллы низшей сингонии характеризуются меньшей симметрией; кристаллы более высокой категории сингонии имеют более совершенную форму кристаллической решетки и, следовательно, являются более устойчивыми в определенных условиях существования.
Многим веществам в кристаллическом состоянии характерен полиморфизм , т.е. способность вещества существовать в виде нескольких кристаллических структур с различными свойствами. Полиморфизм простых веществ называется аллотропией . Известны полиморфные модификации углерода (алмаз, графит), кварца (α-кварц, β-кварц), железа, вольфрама и др.
Если два разных вещества имеют одинаковую кристаллическую структуру, похожую химическую формулу и не очень сильно различаются по размеру составляющих их частиц, то они могут образовывать смешанные кристаллы. Такие вещества называют изоморфными, их способность образовывать смешанные кристаллы – изоморфизмом. Пример: сходные по составу и структуре, но разные по свойствам являются кристаллы каолинита Al 2 O 3 . 2SiO 2 . 2H 2 O, пирофиллита Al 2 O 3 . 4SiO 2 . 2H 2 O и монтмориллонита Al 2 O 3 . 4SiO 2 . 3H 2 O.
Реальные кристаллы. В свей практической деятельности мы имеем дело с реальными кристаллми, которые отличаются от идеальных нарушениями (дефектами) кристаллической решетки, образующимися в результате изменения равновесных условий роста кристаллов, захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий.
Аморфная структура
Аморфная структура является одним из физических состояний твердых тел, Аморфные вещества характеризуются двумя особенностями. Во-первых, свойства таких веществ при обычных условиях не зависят от выбранного направления, т.е. они - изотропны . Во-вторых, при повышении температуры происходит размягчение аморфного вещества и постепенный переход его в жидкое состояние. Точное значение температуры плавления отсутствует.
Общим для кристаллического и аморфного состояний веществ является отсутствие поступательного перемещения частиц и сохранение только их колебательного движения около положения равновесия. Различие между ними состоит в наличии геометрически правильной решетки у кристаллов и отсутствии дальнего порядка в расположении атомов у аморфных веществ.
Аморфное состояние вещества, по сравнению с кристаллическим, всегда менее устойчиво и обладает избыточным запасом внутренней энергии. В связи с этим, при определенных условиях, самопроизвольно осуществляется переход из аморфного состояние в кристаллическое.
Твердые тела в аморфном состоянии можно получить двумя путями. Первый путь – быстрое охлаждение расплавов кристаллических веществ, преимущественно ионного и ковалентного строения. Типичный представитель таких аморфных тел – силикатные стекла, битумы, смолы и пр.
Второй путь – диспергация кристаллических структур. В результате диспергации кристаллических тел образуются аморфизованные дисперсии в виде коллоидов и растворов. Разрушаясь или конденсируясь, дисперсии изменяют свое агрегатное состояние. Пересыщенные растворы, например, могут превратиться в гель и образовать полимер или кристаллизоваться.
Аморфные вещества подразделяют на витроиды (стекла), дисперсные системы и полимеры.
Витроиды – это твердые тела в аморфном состоянии, имеющие стекловидную структуру. Как уже отмечалось, стекла образуются в результате быстрого охлаждения, преимущественно силикатных расплавов. Быстрое охлаждение препятствует созданию упорядоченной структуры. Особенно, если молекулы громоздки, а скорость охлаждения велика.
Твердые тела разделяют на аморфные тела и кристаллы. Отличие вторых от первых состоит в том, что атомы кристаллов располагаются согласно некоторому закону, образуя тем самым трехмерную периодическую укладку, что называется – кристаллическая решетка.
Примечательно, что название кристаллов происходит от греческих слов «застывать» и «холод», и во времена Гомера этим словом называли горный хрусталь, который тогда считался «застывшим льдом». Сперва данным термином называли лишь ограненные прозрачные образования. Но позже, кристаллами стали звать также непрозрачные и не ограненные тела природного происхождения.

Кристаллическая структура и решетка
Идеальный кристалл представляется в виде периодически повторяющихся одинаковых структур – так называемых элементарных ячеек кристалла. В общем случае, форма такой ячейки – косоугольный параллелепипед.
Следует различать такие понятия как кристаллическая решетка и кристаллическая структура. Первая – это математическая абстракция, изображающая регулярное расположение неких точек в пространстве. В то время как кристаллическая структура – это реальный физический объект, кристалл, в котором с каждой точкой кристаллической решетки связана определенная группа атомов или молекул.

Кристаллическая структура граната — ромб и додекаэдр
Основным фактором, определяющим электромагнитные и механические свойства кристалла, является строение элементарной ячейки и атомов (молекул), связанных с ней.
Анизотропия кристаллов
Главное свойство кристаллов, отличающее их от аморфных тел – это анизотропия. Это означает, что свойства кристалла различны, в зависимости от направления. Так, например, неупругая (необратимая) деформация осуществляется лишь по определенным плоскостям кристалла, и в определенном направлении. В связи с анизотропией кристаллы по-разному реагируют на деформацию в зависимости от ее направления.
Однако, существуют кристаллы, которые не обладают анизотропией.
Виды кристаллов

Кристаллы разделяют на монокристаллы и поликристаллы. Монокристаллами называют вещества, кристаллическая структура которых распространяется на все тело. Такие тела являются однородными и имеют непрерывную кристаллическую решетку. Обычно, такой кристалл обладает ярко выраженной огранкой. Примерами природного монокристалла являются монокристаллы каменной соли, алмаза и топаза, а также кварца.

Немало веществ имеют кристаллическую структуру, хотя обычно не имеют характерной для кристаллов формы. К таким веществам относятся, например, металлы. Исследования показывают, что такие вещества состоят из большого количества очень маленьких монокристаллов — кристаллических зерен или кристаллитов. Вещество, состоящее из множества таких разноориентированных монокристаллов, называется поликристаллическим. Поликристаллы зачастую не имеют огранки, а их свойства зависят от среднего размера кристаллических зерен, их взаимного расположения, а также строения межзеренных границу. К поликристаллам относятся такие вещества как металлы и сплавы, керамики и минералы, а также другие.

Молекул в кристалле. Кристаллическая структура определяется кристаллической решёткой, симметрией кристалла, формой и размерами его элементарной ячейки, типом и координатами атомов в ячейке. В идеальном кристалле содержание и положения атомов во всех ячейках одинаковые. За исключением химического состава все остальные характеристики кристаллической структуры определяются дифракционными методами - рентгеновского структурного анализа, электронографии, нейтронографии структурной. В кристаллах твёрдых растворов и при других отклонениях химического состава от стехиометрии структурный анализ высокой точности позволяет определить и уточнить соответствующие параметры.
При падении на монокристалл излучения с длиной волны порядка межатомных расстояний возникает дифракционная картина, которая состоит из дискретного набора пиков. Положения пиков определяются кристаллической решёткой, а их интенсивности зависят от типа атомов и их расположения в элементарной ячейке кристалла. Наличие в кристалле элементов симметрии проявляется в равенстве интенсивностей соответствующих пиков. Исключение составляет то, что дифракционная картина всегда центросимметрична (независимо от наличия или отсутствия центра симметрии в кристалле). Вследствие этого с помощью рентгеноструктурного анализа можно различить только 122 группы из 230 пространственных (фёдоровских) групп симметрии кристаллов. Наличие (или отсутствие) центра симметрии в кристалле можно установить по статистике распределения интенсивностей дифракционных пиков. Экспериментальное определение отсутствия центра симметрии возможно, если в кристалле есть атомы с аномальным рассеянием используемого излучения. Наиболее сложной является методика определения координат атомов в элементарной ячейке кристалла.
Рассмотрим кристаллическую структуру некоторых элементов периодической системы. Так, в двух модификациях полония различной симметрии содержится по 1 атому в элементарной ячейке. В элементарных ячейках кристаллов калия, цинка, молибдена и ряда других элементов содержится по 2 атома, в ячейке теллура - 3, а в двух модификациях марганца по 20 и 58 атомов в ячейке соответственно. В кристаллах неорганических и органических соединений могут находиться от единиц до сотен атомов в ячейке. В кристаллах белков от тысяч до сотни тысяч атомов, а в закристаллизованных вирусах ещё на 2-3 порядка больше.
 Рассмотрим кристаллическую структуру кристаллов различной природы. Кристаллы ниобата лития LiNbO 3 широко применяются в лазерной технике и оптике. На рисунке 1 представлены два изображения его кристаллической структуры. В первом случае атомы - шарики. Крупные анионы кислорода не позволяют увидеть общую организацию строения кристалла. Л. Полинг предложил изображать неорганические структуры в форме полиэдров, вершины которых являются центрами анионов, а внутри полиэдров находится соответствующий катион. В представленном на рисунке 1, б ниобате лития это октаэдры и .
Рассмотрим кристаллическую структуру кристаллов различной природы. Кристаллы ниобата лития LiNbO 3 широко применяются в лазерной технике и оптике. На рисунке 1 представлены два изображения его кристаллической структуры. В первом случае атомы - шарики. Крупные анионы кислорода не позволяют увидеть общую организацию строения кристалла. Л. Полинг предложил изображать неорганические структуры в форме полиэдров, вершины которых являются центрами анионов, а внутри полиэдров находится соответствующий катион. В представленном на рисунке 1, б ниобате лития это октаэдры и .
Кристаллы семейства ниобата стронция-бария Sr 1-x Ba x Nb 2 О 6 характеризуются нелинейными оптическими, пиро и пьезоэлектрическими свойствами (смотри Пироэлектрики, Пьезоэлектричество), которыми можно целенаправленно управлять, меняя соотношение стронция и бария. На рисунке 2 представлена кристаллическая структура этих кристаллов, из которой видно, что часть атомов стронция занимает собственную позицию, а в другой позиции статистически расположены атомы бария и стронция, координаты которых несколько различаются.
 Кристаллические структуры органических соединений обычно представляют собой плотную упаковку молекул, связанных слабыми ван-дер-ваальсовыми и, возможно, водородными связями. Кристаллы органических соединений находят применение в технике, однако часто их получают только для того, чтобы рентгеновскими методами установить атомное строение молекул, так как органические соединения в растворах (а биологически активные соединения в организме) действуют в качестве отдельных молекул. Структуры молекул антибиотиков - аналогов энниатина В и споридесмолида представлены на рисунке 3. Первое соединение является препаратом для избирательного транспорта катионов через биологические мембраны, а второе - лишено этого свойства из-за внутримолекулярных водородных связей, хотя обе молекулы циклические и состоят из 6 аминокислотных остатков. Различие в строении молекул установлено по кристаллической структуре соответствующих кристаллов.
Кристаллические структуры органических соединений обычно представляют собой плотную упаковку молекул, связанных слабыми ван-дер-ваальсовыми и, возможно, водородными связями. Кристаллы органических соединений находят применение в технике, однако часто их получают только для того, чтобы рентгеновскими методами установить атомное строение молекул, так как органические соединения в растворах (а биологически активные соединения в организме) действуют в качестве отдельных молекул. Структуры молекул антибиотиков - аналогов энниатина В и споридесмолида представлены на рисунке 3. Первое соединение является препаратом для избирательного транспорта катионов через биологические мембраны, а второе - лишено этого свойства из-за внутримолекулярных водородных связей, хотя обе молекулы циклические и состоят из 6 аминокислотных остатков. Различие в строении молекул установлено по кристаллической структуре соответствующих кристаллов.
Современный структурный анализ высокой точности позволяет определять не только координаты атомов, но и параметры тепловых колебаний атомов с учётом анизотропии и ангармонизма этих колебаний. Для не очень сложных соединений рентгеноструктурным анализом можно установить распределение электронной плотности в их кристаллах. Структурные методы чувствительны к нарушению стехиометрии химического состава кристалла и к его всевозможным дефектам. Обширный материал о структурах кристаллических веществ представлен в электронных базах данных (смотри Кристаллохимия).
Лит.: Белов Н. В. Структура ионных кристаллов и металлических фаз. М., 1947; он же. Структурная кристаллография. М., 1951; Китайгородский А. И. Органическая кристаллохимия. М., 1947; Федоров Е. С. Симметрия и структура кристаллов. М.; Л., 1949; Бландел Т., Джонсон Л. Кристаллография белка. М., 1979.
Следует различать понятия кристаллическая решётка и структура кристалла . Структура кристалла – это физическая реальность, конкретное расположение в пространстве различных атомов. Кристаллическая решётка – это геометрический образ структуры, отражающий лишь симметрию расположения частиц кристалла. Для более полного описания структуры кристаллов используют понятие базис. Базисом кристаллической структуры называют совокупность определённым образом расположенных в пространстве различных атомов, приходящихся на одну элементарную ячейку. Т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. Таким образом, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Другими словами, базис это тот «элементарный блок вещества», периодическим повторением которого в пространстве воспроизводится весь рассматриваемый кристалл.
Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В простейшем случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Подобная ситуация характерна, в частности, для металлов. Если структуру металла описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то базис такой структуры состоит только из одного атома данного металла. (Действительно, в данном случае, каждый атом металла, расположенный в узле кристаллической решётки, находится на пересечении 8 аналогичных ячеек и принадлежит рассматриваемой ячейке только на ⅛ часть. Но поскольку таких узлов в ячейке 8, то полностью принадлежит ей ровно один атом, составляющий по определению базис. Перемещая этот атом–базис вдоль координатных осей с шагом, соответствующим периодам кристаллической решётки, воспроизводится вся пространственная структура металла). В случае объёмоцентрированной ячейки базис составляют 2 атома металла (атом в центре ячейки полностью принадлежит данной ячейке, плюс один атом дают узлы, расположенные в вершинах ячейки), а гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах граней, принадлежит рассматриваемой ячейке только на ½ часть).
Система симметрии, величина периодов решётки и базис полностью определяют кристаллическую структуру конкретного материала. Если известны эти параметры, то известной считается и структура кристалла. Однако для более полного описания структуры иногда используют такие дополнительные параметры как координационное число и коэффициент компактности. Координационным числом называют число ближайших равноудалённых соседей любого атома. Если в качестве примера рассматривать структуру, изображенную на рис. 1, то для неё координационное число равно шести. Коэффициент компактности (степень компактности) представляет собой отношение объёма, занятого атомами, ко всему объёму элементарной ячейки. В случае чистых металлов коэффициент компактности может достигать величины 0,74. Это означает, что 74 % объёма металла занято атомами, а остальную его часть составляют пустоты (поры).
 Классификация кристаллических структур на основе локализованных в них типах химической связи Если в кристалле связь между всеми атомами одинакова, то такие структуры называют гомодесмическими (от греч. Гомо –одинаковый, десмос –связь) Если в кристалле реализуется несколько типов химической связи, такие структуры называются гетеродесмическими (от греч. гетеро – разные) На основании расположения материальных частиц в кристаллах можно выделить пять геометрически разных типов структур – структурных мотивов: координационный, островной, цепочечный, слоистый и каркасный.
Классификация кристаллических структур на основе локализованных в них типах химической связи Если в кристалле связь между всеми атомами одинакова, то такие структуры называют гомодесмическими (от греч. Гомо –одинаковый, десмос –связь) Если в кристалле реализуется несколько типов химической связи, такие структуры называются гетеродесмическими (от греч. гетеро – разные) На основании расположения материальных частиц в кристаллах можно выделить пять геометрически разных типов структур – структурных мотивов: координационный, островной, цепочечный, слоистый и каркасный.
 Плотнейшие упаковки частиц в кристаллах Постройка из атомов или ионов молекул должна обладать минимальной внутренней энергией Способ заполнения пространства шарами одинакового радиуса, при котором расстояние между центрами частиц минимальны, называются плотнейшими упаковками Гексагональная плотнейшая упаковка получается при последовательной укладке слоев с гексагональной упаковкой слоев. Шары одинакового радиуса в одном слое максимально плотно можно уложить единственным способом: каждый шар окружен в слое шестью ближайшими соседями, между ним и его соседями имеются треугольные промежутки (слой А). Второй плотно упакованной слой тоже можно получить единственным способом: (слой В), у каждого верхнего шара будут три одинаковых соседа в нижнем слое и, наоборот, каждый нижний шар будет соприкасаться с тремя верхними. В гексагональной упаковке шаров третий слой точно повторяет первый, и упаковка оказывается двухслойной и запишется как чередование двух слоев А и В: АВ АВ АВ. В кубической упаковке шаров шары третьего слоя (слой С) находятся над пустотами первого, вся упаковка трехслойная, повторение мотива наступает в четвертом слое, в буквенном обозначении запишется как АВС АВС ….
Плотнейшие упаковки частиц в кристаллах Постройка из атомов или ионов молекул должна обладать минимальной внутренней энергией Способ заполнения пространства шарами одинакового радиуса, при котором расстояние между центрами частиц минимальны, называются плотнейшими упаковками Гексагональная плотнейшая упаковка получается при последовательной укладке слоев с гексагональной упаковкой слоев. Шары одинакового радиуса в одном слое максимально плотно можно уложить единственным способом: каждый шар окружен в слое шестью ближайшими соседями, между ним и его соседями имеются треугольные промежутки (слой А). Второй плотно упакованной слой тоже можно получить единственным способом: (слой В), у каждого верхнего шара будут три одинаковых соседа в нижнем слое и, наоборот, каждый нижний шар будет соприкасаться с тремя верхними. В гексагональной упаковке шаров третий слой точно повторяет первый, и упаковка оказывается двухслойной и запишется как чередование двух слоев А и В: АВ АВ АВ. В кубической упаковке шаров шары третьего слоя (слой С) находятся над пустотами первого, вся упаковка трехслойная, повторение мотива наступает в четвертом слое, в буквенном обозначении запишется как АВС АВС ….

 В плотноупакованном пространстве можно выделить два типа пустот. Пустоты одного типа окружены четырьмя соседними шарами, а пустоты второго типа шестью. Соединив центры тяжести четырех шаров, получим тетраэдр - тетраэдрическую пустоту, во втором случае получим пустоту в форме октаэдра – октаэдрическую пустоту. Все разнообразие структур, построенных на основе плотнейших упаковок, определяют в основном катионные мотивы, т. е. тип, число и расположение занятых пустот. В методе моделирования кристаллических структур, предложенном Л. Полингом, шары, образующие плотнейшую упаковку, всегда соответствуют анионам. Если соединить центры тяжести этих шаров между собой линиями, то все плотноупакованное кристаллическое пространство разбивается на октаэдры и тетраэдры без промежутков.
В плотноупакованном пространстве можно выделить два типа пустот. Пустоты одного типа окружены четырьмя соседними шарами, а пустоты второго типа шестью. Соединив центры тяжести четырех шаров, получим тетраэдр - тетраэдрическую пустоту, во втором случае получим пустоту в форме октаэдра – октаэдрическую пустоту. Все разнообразие структур, построенных на основе плотнейших упаковок, определяют в основном катионные мотивы, т. е. тип, число и расположение занятых пустот. В методе моделирования кристаллических структур, предложенном Л. Полингом, шары, образующие плотнейшую упаковку, всегда соответствуют анионам. Если соединить центры тяжести этих шаров между собой линиями, то все плотноупакованное кристаллическое пространство разбивается на октаэдры и тетраэдры без промежутков.
 Проекция на плоскость хy кристаллической структуры оливина(Mg, Fe)2 Выделены координационные полиэдры – октаэдры – вокруг атомов Mg и Fe (М 1 и М 2) и тетраэдры вокруг атомов Si
Проекция на плоскость хy кристаллической структуры оливина(Mg, Fe)2 Выделены координационные полиэдры – октаэдры – вокруг атомов Mg и Fe (М 1 и М 2) и тетраэдры вокруг атомов Si
 Координационные числа и координационные многогранники (полиэдры) Число ближайших соседей, окружающих данную частицу в структурах кристаллов называется координационным числом. Условный многогранник, в центре которого находится частица, а вершины представлены ее координационным окружением называют координационным полиэдром.
Координационные числа и координационные многогранники (полиэдры) Число ближайших соседей, окружающих данную частицу в структурах кристаллов называется координационным числом. Условный многогранник, в центре которого находится частица, а вершины представлены ее координационным окружением называют координационным полиэдром.


 Островные структуры состоят из отдельных конечных группировок (часто молекул). В структуре кристаллического хлора, построенной из отдельных молекул Cl кратчайшее расстояние между двумя атомами Cl отвечает ковалентной связи, тогда как минимальное расстояние между атомами хлора из разных молекул отражает межмолекулярное взаимодействие, т. е. ван-дер-ваальсову связь.
Островные структуры состоят из отдельных конечных группировок (часто молекул). В структуре кристаллического хлора, построенной из отдельных молекул Cl кратчайшее расстояние между двумя атомами Cl отвечает ковалентной связи, тогда как минимальное расстояние между атомами хлора из разных молекул отражает межмолекулярное взаимодействие, т. е. ван-дер-ваальсову связь.

 Цепочечные структуры могут состоять как из нейтральных, так и из валентно-насыщенных цепочек. Между атомами селена связь ковалентная, а между атомами из соседних цепочек ван-дер-ваальсова. В структуре. Na. HCO 3, водородные связи выстраивают карбонатные ионы (HCO 3)- в цепи, связь между которыми осуществляется через ионы Na+
Цепочечные структуры могут состоять как из нейтральных, так и из валентно-насыщенных цепочек. Между атомами селена связь ковалентная, а между атомами из соседних цепочек ван-дер-ваальсова. В структуре. Na. HCO 3, водородные связи выстраивают карбонатные ионы (HCO 3)- в цепи, связь между которыми осуществляется через ионы Na+